-
O que previne:
.
Do que é feita:
No Brasil estão disponíveis duas vacinas: a produzida por Bio-Manguinhos – Fiocruz, utilizada pela rede pública, e a produzida pela Sanofi Pasteur, utilizada pelos serviços privados de vacinação e eventualmente pela rede pública. Ambas são elaboradas a partir de vírus vivo atenuado, cultivado em ovo de galinha. A vacina de Biomanguinhos apresenta em sua formulação gelatina bovina, eritromicina, canamicina, cloridrato de L-histidina, L-alanina, cloreto de sódio e água para injeção. Já a da Sanofi Pasteur contém: lactose, sorbitol, cloridrato de L-histidina, L-alanina e solução salina.
As duas têm perfis de segurança e eficácia semelhantes, estimados em mais de 95% para maiores de 2 anos.
É importante ressaltar que os estudos para o uso de doses fracionadas, recomendado apenas durante campanhas do Ministério da Saúde, em localidades e períodos bem definidos, foram realizados apenas com a vacina de Bio-Manguinhos. Não há, portanto, autorização para a administração de doses fracionadas da vacina da Sanofi Pasteur.
Indicação:
Pessoas a partir de 9 meses de idade.
Contraindicações:
- Crianças abaixo de 6 meses de idade.
- Indivíduos infectados pelo HIV, sintomáticos e com imunossupressão grave comprovada por exame de laboratório.
- Pessoas com imunodepressão grave por doença ou uso de medicação.
- Pacientes que tenham apresentado doença neurológica desmielinizante no período de seis semanas após a aplicação de dose anterior da vacina.
- Gestantes, salvo em situações de alto risco de infecção, o que deve ser avaliado pelo médico;
- Mulheres amamentando bebês com até 6 meses. Se a vacinação não puder ser evitada, suspender o aleitamento materno por 10 dias. Procure o pediatra para mais orientações.
- Pacientes submetidos a transplante de órgãos.
- Pacientes com câncer.
- Pessoas com história de reação anafilática relacionada a substâncias presentes na vacina (ovo de galinha e seus derivados, gelatina bovina ou outras).
- Pacientes com história pregressa de doenças do timo (miastenia gravis, timoma, casos de ausência de timo ou remoção cirúrgica).
- Em princípio há contraindicação para gestantes, mas a administração deve ser analisada de acordo com o grau de risco, por exemplo, na vigência de surtosrianças abaixo de 6 meses de idade.
Grupos com precaução para vacinação:
Em situações de aumento das chances de infecção pelo vírus selvagem da febre amarela, a vacinação pode ser recomendada para pessoas com algumas condições clínicas que inicialmente seriam consideradas contraindicação. Cabe a(o) médico(a) avaliar a relação risco-benefício.
- Indivíduos a partir de 60 anos não previamente vacinados: embora raro, está descrito risco aumentado de eventos adversos graves na primovacinação nesta faixa etária;
- Pessoas vivendo com HIV/Aids, assintomáticas e que apresentem o LT-CD4 ≥ 350 células/mm3. Poderá ser utilizado o último exame de LT-CD4 (independentemente da data), desde que a carga viral atual (menos de seis meses) se mantenha indetectável;
- Pessoas após término de tratamento com quimioterapia (venosa ou oral) e sem previsão de novo ciclo: administrar a vacina após três meses do término da quimioterapia;
- Pessoas que fizeram uso de medicamento anticélulas B e Fludarabina: aguardar seis meses de intervalo;
- Pessoas submetidas a transplante de células tronco hematopoiéticas: administrar a vacina a partir de 24 meses após o transplante se não houver doença do enxerto versus hospedeiro e/ou recaída da doença de base e/ou uso de imunossupressor;
- Síndrome Mieloproliferativa Crônica: administrar a vacina se padrão laboratorial for estável e com neutrófilos acima de 1500 céls/mm³;
- Síndrome Linfoproliferativa: administrar a vacina três meses após o término da quimioterapia (exceto no caso de uso de medicamento anti-células B, quando o intervalo deve ser de seis meses);
- A administração da vacina em pacientes com lúpus eritematoso sistêmico ou outras doenças autoimunes deve ser avaliada com cuidado, pois pode haver imunossupressão nesses pacientes.
- Doenças hematológicas:
- Hemofilia e doenças hemorrágicas hereditárias: administrar a vacina conforme orientação do Calendário Nacional de Vacinação. Recomenda-se o uso de compressas frias antes e depois da aplicação da vacina;
- Doença Falciforme: sem uso de hidroxiureia: administrar a vacina conforme o Calendário Nacional de Vacinação; em uso de hidroxiureia: administrar a vacina somente se contagem de neutrófilos acima de 1500 céls/mm³;
Esquema de doses:
Rotina
- Crianças até 4 anos: duas doses, aos 9 meses e aos 4 anos;
- A partir de 5 anos: O PNI disponibiliza dose única. A SBIm, no entanto, recomenda duas doses, com intervalo de 10 anos, pois há dados que demonstram perda de proteção com o tempo (falha secundária);
- No PNI, pessoas a partir de 5 anos de idade que receberam uma dose da vacina antes de completarem 5 anos de idade devem receber uma segunda dose, independentemente da idade em que procurarem o serviço de vacinação, respeitando intervalo mínimo de 30 dias entre as doses (saiba mais).
Observação: A dose fracionada da vacina febre amarela, utilizada pelo Ministério da Saúde para conter o surto de grandes proporções que atingiu o Brasil em 2018, é considerada válida para fins de esquema (de uma ou duas doses), mas não é aceita para a emissão do CIVP. Pessoas que precisam se deslocar para países que exigem o documento, precisam ter recebido pelo menos uma vacina com dosagem plena, no mínimo 10 dias antes da viagem.
Exigência de vacinação para viajantes
Como o Brasil é considerado endêmico para a febre amarela, alguns países (acesse a lista) só permitem a entrada de viajantes brasileiros que apresentem o Certificado Internacional de Vacinação e Profilaxia (CIVP) com registro de dose aplicada no mínimo 10 dias da viagem. A dose fracionada não é válida para esse fim.
Para obter o documento é necessário procurar os serviços públicos ou privados habilitados ou acessar o site da Agência Nacional de Vigilância Sanitária (Anvisa) para emissão online. Mais informações em https://www.gov.br/pt-br/servicos/obter-o-certificado-internacional-de-vacinacao-e-profilaxia ou por meio do telefone 0800-642-9782.
Quando há contraindição para a vacinação, o médico(a) poderá emitir o certificado de isenção da vacinação contra febre amarela com a justificativa da isenção. Para informações sobre como obter este certificado, acesse https://civnet.anvisa.gov.br/app/viajante/login?wicket-crypt=CMd8D9wZbAY
Via de aplicação:
Subcutânea.
Cuidados antes, durante e após a vacinação:
- Não são necessários cuidados especiais antes da vacinação.
- Em caso de febre recomenda-se adiar a vacinação até a melhora.
- Para crianças até 2 anos de idade, não aplicar simultaneamente com a vacina tríplice viral e aguardar intervalo mínimo de 30 dias entre as duas vacinas.
- Qualquer sintoma grave e/ou inesperado após a vacinação deve ser notificado ao serviço que a realizou.
- Todo e qualquer evento adverso grave e/ou inesperado deve ser notificado às autoridades de Saúde.
Efeitos e eventos adversos:
- Manifestações gerais, como febre, dor de cabeça e muscular são os eventos mais frequentes e acontecem em cerca de 4% dos que são vacinados na primeira vez e menos de 2% nas segundas doses.
- Manifestações locais como dor na área de aplicação ocorrem em 4% dos adultos vacinados e um pouco menos em crianças pequenas. A dor dura um ou dois dias, na forma leve ou moderada.
- Reações alérgicas como erupções na pele, urticária e asma acontecem com frequência de um caso para 130 mil a 250 mil vacinados.
- Apesar de muito raros, podem acontecer eventos graves: reações alérgicas, doença neurológica (encefalite, meningite, doenças autoimunes com envolvimento do sistema nervoso central e periférico) e doença em órgãos (infecção pelo vírus vacinal causando danos semelhantes aos da doença). No Brasil, entre 2007 e 2012, a ocorrência destes eventos graves foi de 0,42 caso por cem mil vacinados.
- Entre 1999 e 2009, ocorreu anafilaxia na proporção de 0,023 caso para cem mil doses aplicadas.
- Entre 2007 e 2012, aconteceram 116 casos (0,2 caso em cem mil vacinados) de doença neurológica, principalmente quando se tratava de primeira dose e em idosos. Já a doença nos órgãos, chamada “viscerotro?pica”, neste mesmo período, ocorreu em 21 pessoas (0,04 caso em cem mil vacinados).
Onde pode ser encontrada:
Nos serviços privados de vacinação credenciadas junto à Anvisa e nas Unidades Básicas de Saúde.
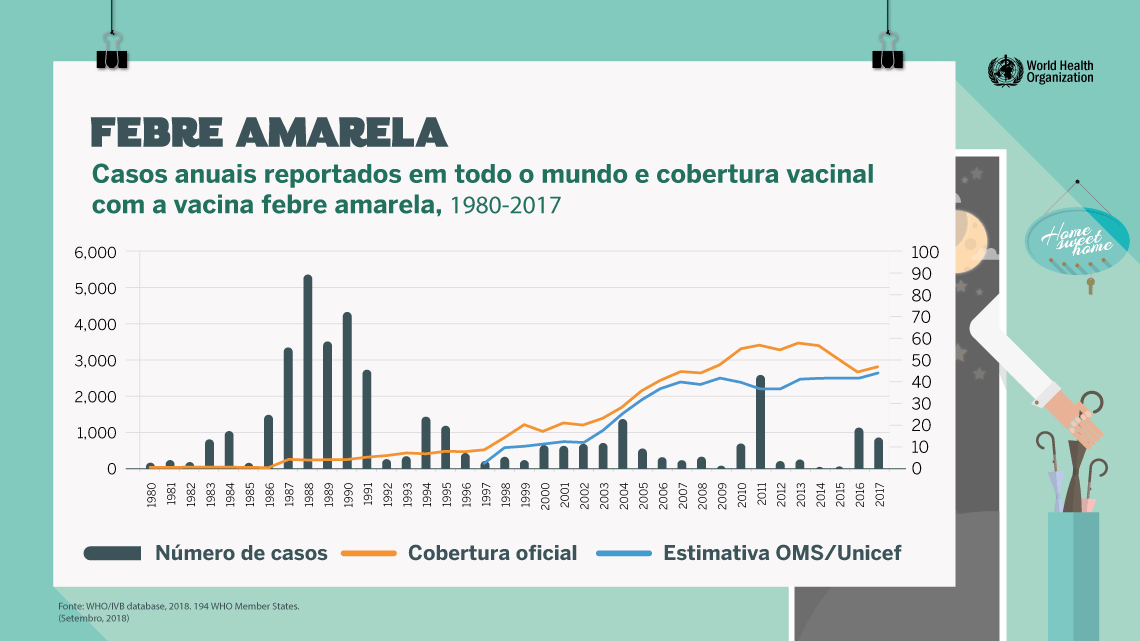
Resultados da vacinação no mundo: